
Bättre diagnostisering och behandling av hjärntumörer
En unik kombination av genteknologi och artificiell intelligens leder till säkrare sätt att diagnostisera tumörer. Snart kommer metoden att erbjudas inom vården, berättar Joakim Lundeberg, professor och en av Barncancerfondens forskare.
Joakim Lundeberg är professor och forskare i genteknologi vid KTH och SciLifeLab. Hans team har ett anslag på tre miljoner från Barncancerfonden för att göra analyser av tumörcellernas genetik med hjälp av digital teknik. Nu är de snart i mål.
Forskargruppen har studerat hur och när olika gener i en tumörcell är ”påslagna”, aktiva, och var i tumören de då befinner sig. Genom att föra in uppgifter från en mängd olika tumörer i ett dataprogram går det att på ett nytt sätt se hur en tumör är uppbyggd och fungerar, och hur förändringar av generna uppstår.
Hur har det gått sedan sist?
– Vi har lyckats etablera alla delar som behövs för att skapa ”digitala fingeravtryck”, av en tumör. Nu återstår bara att gå igenom många fler prover på hjärntumörer och karaktärisera och klassificera dem, för att skapa en bättre kartläggning, säger Joakim Lundeberg.
Egentligen skulle projektet ha avslutats under hösten 2018, men den sista delen har skjutits upp eftersom en doktorand som jobbat i projektet är föräldraledig.
– Vi har skjutit fram projektavslutet och hoppas nu hinna med ännu fler analyser för att öka vår chans att söka och få nya medel för att kunna etablera och erbjuda metoden till vården. Vi tänkte använda en plattform, Clinical Genomics inom SciLifeLab, som redan har etablerat sig kliniskt genom att erbjuda analys av arvmassan.
I väntan på det befinner sig Joakim Lundeberg på ett utbyte på Stanford University i Kalifornien, där han försöker hitta ytterligare nya idéer på hur det går att dra nytta av artificiell intelligens för att tolka bilder som man får via histologi, ljus- och elektronmikroskop, när man diagnostiserar tumörer.
– Målet är ju att kombinera detta i en digital plattform för framtidens diagnostik, så att tolkning och analys blir betydligt mer säker och objektiv, säger Joakim Lundeberg.
Med den nya detaljerade informationen som forskarna får fram blir det möjligt att behandla patienter skräddarsytt efter just deras tumör.
Det kommer också att bli lättare att upptäcka förstadier till cancer och på sätt kunna behandla mycket tidigare i dag, och på ett mer individuellt sätt.
– Det innebär att vi får en helt ny typ av diagnostik som så småningom kommer att ha stor påverkan i vården. Jag tror att vi kommer att se att detta är rutin i vården inom fem år, men att metoden kommer att finnas tillgänglig tidigare än så, säger Joakim Lundeberg.
Så funkar metoden:
Forskargruppens metod innebär att information om vilka cancerceller i en tumör som är aktiva och vilken aktivitet de uppvisar, sparas tillsammans med information var i vävnaden som de aktiva cancercellerna sitter. Därefter görs en dataanlays.
Steg 1 - Histologi
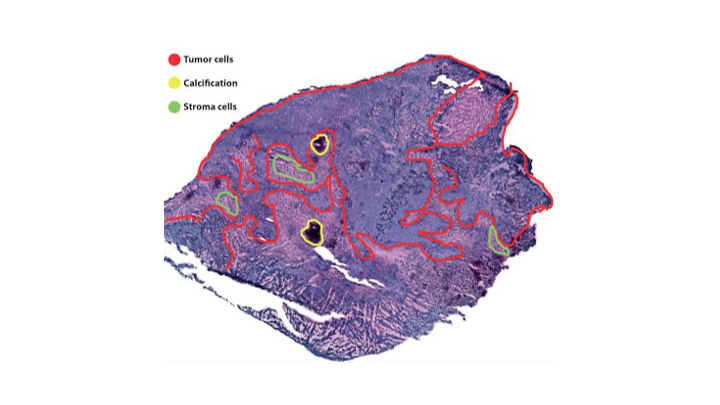
Forskarna tar ett litet vävnadssnitt från en tumörbiopsi och undersöker dem histologiskt, via ljusmikroskop eller elektronmikroskop.
De färgar vävnadssnittet med så kallad HE-färgning (hematoxylin-eosin), cellkärnan färgas lilablå och cytoplasman färgas rödrosa.
En patolog tittar på vävnaden och ritar in vad som är tumör och vad som är vävnad.
Steg 2 - Sekvensering

Samma bit vävnad kan sedan med metoden RNA-sekvenseras därefter. Det innebär att allt RNA i en viss vävnad mäts vid en viss tidpunkt och forskarna kan se vilka gener som är aktiva och hur aktiva de är.
Steg 3 - Dataanalys
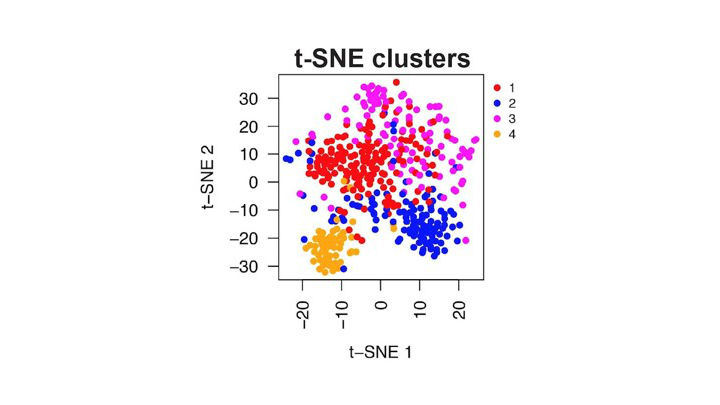
Forskarna gör dataanalyser av informationen de får ut efter sekvenseringen. Det är i detta steg man kan utnyttja bioinformatik, och senare artificiell intelligens, för att tolka och beskriva vad som händer i vävnadssnittets olika delar.
Det kan till exempel vara intressant att titta på genuttrycket hos de tumörceller som ligger i kanten av en tumör och är på väg att infiltrera normal vävnad.
(Ett genuttryck är processen som omvandlar informationen i en gen till en produkt, de olika steg genom vilken informationen från en gens DNA-sekvens överförs till cellens strukturer och vad den har som uppgift).
Steg 4 - Heterogenitet
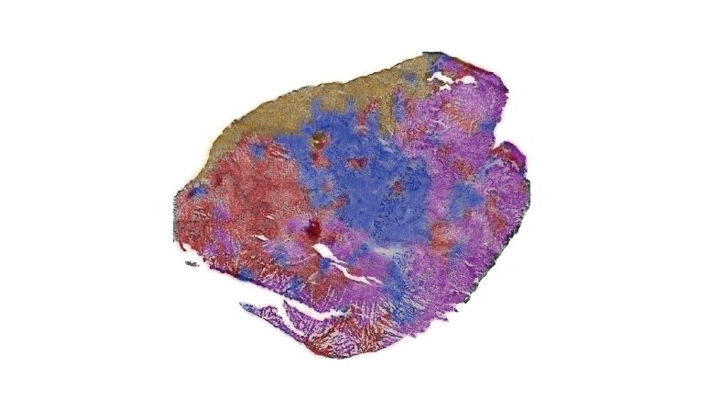
Efter dataanalysen kan man sedan visualisera vad man hittat direkt tillbaka på vävnaden från tumören man analyserat.
Denna vävnadsbit består till exempel främst av tumörceller, men det finns en viss heterogenitet, det vill säga att genuttrycket skiljer sig åt hos tumörcellerna i olika delar av tumören.
Detta sätt att analysera en biopsi ska förhoppningsvis i framtiden hjälpa till att förbättra diagnos, prognos och behandlingsstrategi.