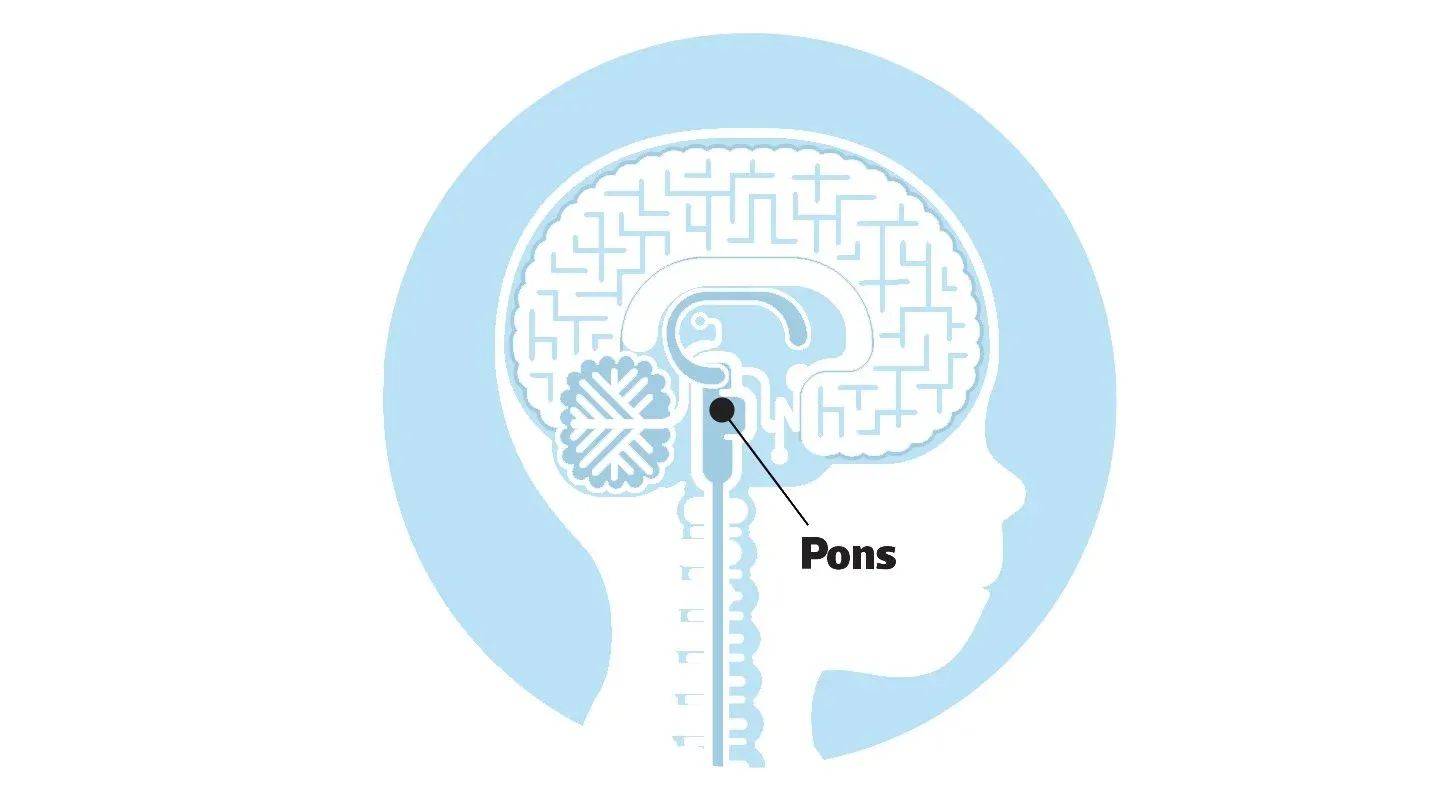
Intensiv forskning pågår för att öka överlevnaden för ponsgliom
Hjärntumören ponsgliom är en barncancerform som i dag är obotlig. Endast 10 procent av de barn som drabbas överlever mer än två år efter diagnos. Forskningen som pågår sträcker sig från grundforskning till kliniska prövningar. Ökad förståelse för hur tumören uppstår behövs för att kunna ta fram mer effektiva behandlingsmetoder och nya läkemedel för att på sikt kunna öka överlevnaden.
Ponsgliom är en i dag obotlig form av hjärntumör som framför allt drabbar barn. Cancerformen kallas också DIPG, en förkortning av det engelska namnet ’diffuse intrinsic pontine glioma,’ och ingår i en grupp tumörer som kallas medellinjesgliom. Ponsgliom sitter i ett område i och runt hjärnstammen, och anses vara bland de mest svårbehandlade formerna av barncancer.
Svårbehandlad på grund av placering och form
Anledningarna till att ponsgliom är svåra att behandla är många. Tumörernas placering vid hjärnstammen gör dem extremt svåra att operera bort eftersom det finns en väldigt stor risk att skada vitala funktioner som andning, puls och vakenhet, som styrs av hjärnstammen.
Tumörerna är också vad som kallas diffusa, det vill säga att cancercellerna inte är samlade i en kompakt tumör utan är uppblandade med friska celler. Detta försvårar strålbehandling, eftersom den bör riktas så precist och exakt som möjligt för att minimera risken att skada frisk vävnad.
Behandling av ponsgliom med cytostatika, som är effektivt mot många andra barncancerformer, har inte visat sig öka överlevnaden mer än marginellt. En anledning till detta är att mediciner som ges mot hjärntumörer måste kunna gå över den så kallade blod-hjärnbarriären, det skyddande lager i hjärnans blodkärl som skyddar hjärnan genom att förhindra att till exempel bakterier eller farliga ämnen når hjärnans celler.
I dag behandlas de barn som drabbas av ponsgliom i Sverige med strålbehandling i kombination med ett läkemedel, everolimus, som i studier visat sig kunna hämma tillväxten av cancerceller.

Hoppas på en verktygslåda
För många andra barncancerformer finns det ofta flera olika typer av läkemedel och behandlingsformer som kan kombineras på olika sätt för att se vad som fungerar bäst. Men så är det ännu inte för ponsgliom, vilket gör forskning för att öka kunskapen om hur tumören fungerar och forskning som syftar till att ta fram nya läkemedel för att behandla ponsgliom oerhört viktig.
– Det vi hoppas på är att vi med hjälp av forskning kan få fram en verktygslåda av flera olika läkemedel och behandlingsalternativ som vi kan använda i behandlingen av de här tumörerna, säger Klas Blomgren, professor i pediatrik vid Karolinska institutet, barncancerforskare och barncancerläkare vid Astrid Lindgrens barnsjukhus.

Kliniska studier och internationellt samarbete
Men forskningen om ponsgliom går framåt, även om vägen från forskningsresultat till nya behandlingsformer kan vara lång. En utmaning med framställning av nya läkemedel är att de måste genomgå kliniska tester, det vill säga att de under kontrollerade former måste testas på patienter. Detta görs för att säkerställa att de har en bra effekt, men också för att se så att de inte ger svåra biverkningar. Den processen tar tid, och kräver ett stort patientunderlag.
Internationella samarbeten är därför viktiga, och i Sverige finns två enheter för kliniska prövningar som ingår i det internationella så kallade ITCC-samarbetet, HOPE-kliniken vid Karolinska universitetssjukhuset och Barncancercentrums forskningsenhet i Göteborg.
När ett barn drabbas av ponsgliom görs ofta olika typer av provtagningar för att se om det pågår några kliniska studier någonstans som skulle kunna tänkas passa just detta ponsgliom. Då har den drabbade familjen möjlighet att själva välja om de vill delta i studien.
Milstolpe för forskningen
För ungefär tio år sedan gjordes ett enormt viktigt forskningsframsteg som gav ny förståelse för hur ponsgliom uppstår i hjärnan.
I alla celler finns en grupp av proteiner som kallas histoner. De ansvarar för att packa och snurra ihop dna-strängar inne i cellens kärna. För ungefär 10 år sedan upptäcktes specifika mutationer i det så kallade H3-histonet, som har visat sig ha en central funktion i uppkomsten av ponsgliom. Om det sker en så kallad H3K27M-mutation under ett barns tidiga år sätts olika processer i gång i cellerna vilka i sin tur kan leda till nya mutationer. Tillsammans leder de här olika processerna till att onkogena proteiner aktiveras, vilket bidrar till att cancerceller kan börja växa och bilda tumören ponsgliom.
– Upptäckten av mutationer i H3-histonet var oerhört positivt, en riktig milstolpe inom forskningen om ponsgliom. Men det innebär också att vi har det svåraste kvar. Vi har ökat vår kunskap, men det vi har kvar är att knäcka den sista och svåraste frågan. Att hitta ett läkemedel som kan göra att vi får en ökad överlevnad, säger Fredrik Swartling, lektor vid institutionen för Immunologi, genetik och patologi vid Uppsala universitet, som forskat mycket om biologin kring hjärntumörer hos barn.

Forskningsstrategi framåt
Barncancerfonden är Sveriges enskilt största finansiär av forskning om barncancer, och varje år tilldelas flertalet olika forskningsprojekt om ponsgliom och andra hjärntumörer nya anslag. Samtidigt har också många barncancerforskare sina tjänster helt eller delvist finansierade av Barncancerfonden.
– I Sverige har vi forskning inom många av de områden som just nu ses som de mest intressanta inom ponsgliom-forskningen. Det visar att även ett litet land som Sverige har stark forskning och kan bidra stort i den internationella forskningen. För den här typen av klinisk forskning är rätt patienter viktigare än många patienter. Viktigt är också att barn i Sverige genom de internationella studierna BIOMEDE kan få tillgång till de nyaste läkemedlen. När prognosen är så dålig kan medverkan i studier vara det mest hoppfulla vi kan erbjuda, säger Britt-Marie Frost, forskningschef på Barcancerfonden.
Barncancerfonden stöttar förutom enskilda forskningsprojekt också olika typer av infrastrukturer som är en förutsättning för att både grundvetenskaplig och klinisk forskning.
– För att öka chansen att få vara med i en studie så har Barncancerfonden också varit med och bidragit till att starta prövningseneheten HOPE. Vi stöttar även INFORM, en registerstudie som syftar till att förbättra förståelsen av genetiska förändringar i tumörer vid återfall av cancer hos barn och unga. Barncancerfonden stöttar också GMS Barncancer som genom helgenomsekvensering kan bidra till nya behandlingsstrategier för patienter genom att individualisera behandlingen baserad på genetiska information.

7 aktuella forskningsspår om ponsgliom
-
1. Internationella studier: BIOMEDE och BIOMEDE 2.0
I slutet av 2021 avslutades en stor internationell klinisk studie, BIOMEDE, som delvis finansierats av Barncancerfonden. Från de barn som deltog i studien togs en biopsi, ett litet vävnadsprov, av tumören, som skickades till ett franskt forskningslaboratorium för en genetisk analys. Resultatet av biopsin avgjorde sedan vilket av tre läkemedel som patienten skulle behandlas med. Förutom det utvalda läkemedlet genomgick alla patienter även strålbehandling, som visat sig sedan tidigare kunna hämma tillväxten och även till viss del krympa ponsgliom.
De preliminära resultaten från studien, där ca 12 patienter från Sverige också ingick, visar att ett av läkemedlen hade en något bättre effekt än de andra två. Tumörerna hos de barn som fick everolimus i kombination med strålbehandling krympte mer, vilket också till viss del bidrog till att de patienterna överlevde något längre än de andra. Tack vare BIOMEDE-studien ges nu everolimus i kombination med strålbehandling till alla barn i Sverige som får diagnosen ponsgliom.
Under 2023 kan förhoppningsvis Sverige ansluta till den uppföljande studien, BIOMEDE 2.0, genom de båda ITCC-klinikerna i samarbete med alla barnonkologiska kliniker i landet. Studien har redan startat i Frankrike, men de dokument som krävs för att övriga länder ska kunna ansluta är ännu ej klara. I den kommer everolimus att fortsätta användas men nu som kontroll, det vill säga som det man vill jämföra ett annat läkemedel mot. Det nya läkemedlet som nu ska testas heter ONC 201. Det är ett läkemedel som ursprungligen tagits fram för något helt annat men som visat sig vara effektivt för att krympa medellinjesgliom. Varför det fungerar är forskare ännu inte riktigt på det klara med. Läkemedlet ONC 201 är redan i dag tillgängligt i begränsad omfattning i Europa för behandling av medellinjesgliom, men då utanför kliniska studier vilket innebär att patienter själva får betala den mycket kostsamma behandlingen.
-
2. K27M-mutationer
När det blev känt att K27M-mutationer är en stor bidragande orsak till att ponsgliom uppstår öppnades en helt ny väg för forskningen. I dag pågår mycket forskning runt om i världen för att lära sig mer om mekanismerna bakom K27M-mutationerna, samt för att försöka hitta ett läkemedel som kan hämma dessa mutationer och därigenom förhindra tillväxten av cancerceller. Utmaningarna med att hitta effektiva hämmare mot K27M-mutationer är många. Dels finns K27-proteinet inne i cellernas kärna, så ett läkemedel med uppgift att hämma mutationerna måste kunna ta sig igenom cellväggen och in i cellkärnan. Dessförinnan behöver också läkemedlet kunna korsa den så kallade blod-hjärnbarriären, som finns till för att skydda hjärnan mot farliga ämnen.
-
3. MYC-hämmare
MYC är en familj av gener som har olika regulatoriska funktioner i cellerna. Deras roll är, enkelt beskrivet, att påverka proteiner som bidrar till att sätta i gång eller stänga av olika processer. På så vis fungerar det på ett liknande sätt som K27. MYC-proteiner är främst inblandade i celldelning, men har också förmågan att dra till sig blodkärl som cellerna behöver för att få syre.
MYC-gener finns naturligt i kroppen i ung ålder, men ska stängas av eller minska när barnet blir äldre. Men forskning har visat att hos många som utvecklar barncancer förekommer höga nivåer av MYC, det vill säga att den naturliga avstängningen av generna inte har fungerat. Då blir MYC-proteinerna i stället onkogena, det vill säga att de bidrar till att cancerceller börjar växa och sprida sig.
Fredrik Swartling och hans forskarlag vid Uppsala universitet forskar om MYC-gener och hur de fungerar, samt vilken betydelse de har för uppkomsten och tillväxten av olika hjärntumörer, däribland ponsgliom. Hans forskning, som Barncancerfonden är med och finansierar, fokuserar på att hitta ett effektivt sätt att hämma MYC-generna. Utmaningen består bland annat i att MYC-generna finns inne i cellkärnan, och en MYC-hämmare måste alltså kunna passera cellväggen och ta sig hela vägen in till cellens kärna för att fungera. Den andra utmaningen, som gäller för alla läkemedel mot meddellinjesgliom, är att de måste kunna ta sig över blod-hjärnbarriären.
-
4. Modifierade virus kan skapa ingång
Virus är partiklar som enkelt kan ta sig runt i hela kroppen med hjälp av blodet, men vissa har också förmågan att ta sig över blod-hjärnbarriären. Forskning för att ta fram olika typer av modifierade virus, som i stället för att bära på olika sjukdomar skulle kunna bära på viktiga byggstenar för att bekämpa cancerceller med så kallad genterapi, är därför ett viktigt spår för att hitta effektiva behandlingsmetoder för medellinjesgliom.
Onkolytiska virus är en grupp virus som designats till att bli en slags målsökande robot, genom att de kan ta sig in och föröka sig i cancercellerna och till slut spräcka dem inifrån. En annan grupp, så kallade adeno-associerade virus, kan också modifieras för att ta sig in i hjärnan via blod-hjärnbarriären och söka upp och slå ut cancerceller med någon form av genterapi. Fredrik Swartlings forskarlag vid Uppsala universitet håller just nu på med en modellstudie där de testar olika typer av adeno-associerade virus för att se om de kan ta sig in till rätt plats i hjärnan och till barnhjärntumörer. Varianter av dessa virus har visat sig specifikt kunna infektera hjärnceller och anses säkrare att använda kliniskt då de till skillnad från många andra typer av virus inte ger någon stark immunrespons.
-
5. CAR-T-behandling väcker hopp
Kroppens egna immunförsvar består bland annat av så kallade T-celler, en typ av vita blodkroppar som kan identifiera och oskadliggöra vissa typer av patogener i kroppen, till exempel virus och bakterier. CAR-T-celler är en slags modifierade T-celler, som har förändrats i ett laboratorium så att de kan känna igen och oskadliggöra cancerceller. Den här så kallade immunologiska behandlingsmetoden har visat sig väldigt effektiv, och används redan i dag för vissa typer av leukemier och lymfom.
På bland annat Stanford-universitetet i USA pågår forskning för att ta fram CAR-T-celler som kan användas mot solida tumörer. Vissa försök har redan gjorts på patienter med ponsgliom, men med än så länge osäkra resultat. En svårighet med den här experimentella behandlingsformen ligger i att de administrera de modifierade blodkropparna in i tumören, vilket är svårt med hjärntumörer eftersom CAR-T-celler inte är så effektiva på att korsa blod-hjärnbarriären och inte alltid hittar rätt. Försök görs också för att injicera CAR-T-celler in i de hålrum, ventriklar, som finns i hjärnan. Där kan de tas upp av cerebrospinalvätskan och därigenom föras in i tumören.
Immunterapi med CAR-T-celler är också riskfyllt då den kan orsaka svåra biverkningar, till exempel kan immunförsvaret reagera för starkt vilket kan orsaka akuta sjukdomstillstånd. I dagsläget är en stor risk med den här typen av behandling för hjärntumörer att hjärnan eller hjärnstammen kan svullna, vilket kan innebära stor fara för patienten.
-
6. Grundforskning om mikrogliaceller
Förståelsen för hur ponsgliom och andra medellinjesgliom uppstår har ökat mycket de senaste 10–15 åren. Men fortfarande finns många frågor kvar att besvara. Att genom så kallad grundforskning lära sig mer om tumörerna och hur de fungerar kan i förlängningen också bidra till att forskningen hittar nya spår att följa i jakten på en mer effektiv behandling.
Ett intressant sådant spår handlar om betydelsen av mikrogliaceller. Vid Karolinska institutet i Solna pågår just nu forskning, finansierad av Barncancerfonden, som syftar till att lära sig mer om mikrogliacellers betydelse för uppkomsten och tillväxten av ponsgliom.
Mikrogliaceller är en del av nervsystemet och finns naturligt i hjärnans vita och grå substans. De ingår, precis som de vita blodkropparna, i kroppens eget immunförsvar och kan identifiera och ”äta upp” vissa typer av främmande och skadliga celler. Mikrogliacellers funktion är med andra ord att skydda hjärnan, men hos patienter med ponsgliom har man kunnat se att mikrogliaceller omprogrammerats till att i stället skydda cancercellerna.
En förhoppning med den forskning som pågår är att man i framtiden ska kunna vända den här programmeringen, att i stället kunna använda mikrogliaceller som en del i försvaret mot cancertumören.
-
7. Medicinteknik
Vid sidan av de olika spår för att ta fram mer effektiva läkemedel mot ponsgliom pågår också forskning inom medicinteknik. Svenska forskare, där bland annat Staffan Holmin, professor vid Karolinska institutet, Klas Blomgren och Fredrik Swartling ingår, håller med hjälp av finansiering från Barncancerfonden på att ta fram ett instrument som ska kunna föras in i tumören via blodkärlen. Väl på plats kan sedan instrumentet administrera läkemedel rakt in i tumören.
Metoden har testats i djurmodeller, men i dagsläget finns några utmaningar kvar att lösa. En svårighet handlar om att de blodkärl som leder in i hjärnan på de smådjur som modell-testerna görs på, är placerade i en snäv vinkel som instrumentet behöver kunna navigera igenom. För att kunna visa att tekniken är säker behöver forskarna först kunna visa att den fungerar i modeller – innan den kan testas på patienter.
Men om den här tekniken utvecklas mer skulle den i framtiden kunna hjälpa till att både ta prov från och föra in olika typer av läkemedel, som cytostatika, CAR-T-celler, eller modifierade virus rakt in i tumören.